
LE SYSTEME PHENOPSIS
La plate-forme PHENOPSIS et ses expérimentations
La plate-forme PHENOPSIS est composée de 3 automates (PHENOPSIS 1, 2 et 3) qui permettent de peser, irriguer précisément et prendre des photos des plantes d'Arabidopsis thaliana individuellement dans des conditions environnementales rigoureusement contrôlées. Ces 3 automates sont placés dans 3 chambres de culture différentes (C1, C2 et C3).
Les automates PHENOPSIS ont été construits par la société Optimalog. Retrouvez sur leur site les caractéristiques des automates PHENOPSIS.
Les expérimentations : Chaque expérimentation débute à une date précise (mise en place du premier pot dans la chambre de culture) et se termine quand le dernier pot est sorti. Chaque identifiant d'une expérimentation est de la forme CiMj, avec i le numéro de la chambre, et j le numéro de l'expérimentation. Cet identifiant peut être suivi d'une lettre (A, B, etc.) si plusieurs expérimentations ont eu lieu simultanément dans une chambre de culture.
Les conditions micro-météorologiques : La régulation du climat dans les chambres de culture est réalisée par une acquisition de données CR10 (Campbell) contrôlant des actionneurs (chaud, froid, humidité) commandés par les consignes programmées. Elles peuvent changer en cours d'expérimentation à une date précise ou à un stade de développement précis.
Les conditions micro-météorologiques dans les chambres de culture (la température de l'air, l'humidité de l'air et le rayonnement incident) sont mesurées en continu par différents capteurs avec un pas de temps de 10s pendant toutes les expérimentations, et elles sont moyennées toutes les 10 minutes.
Les pots d'une expérimentation : L'automate est composé d'un cadre en acier supportant 14 plateaux (numérotés de P1 à P14) comprenant chacun 36 alvéoles (numérotées de A1 à A36) pouvant contenir chacune 1 pot. Les 504 pots d'une expérimentation sont numérotés de 1 à 504 ou de 505 à 1008 et définis par un identifiant de la forme CiMj-k, k étant le numéro du pot. Ils sont également repérés par leur position dans la chambre de culture de la forme Px_Ay avec x le numéro de plateau et y le numéro d'alvéole.

Plateaux des chambres de culture
Certains pots sont fendus sur les côtés et au fond du pot de manière à permettre un dessèchement homogène du substrat lors d'expérimentations visant à tester l'effet de déficits hydriques du sol : ce sont les pots troués. D'autres pots ne sont pas fendus : ce sont les pots non troués. Suivant le scénario de dessèchement du sol pendant l'expérimentation, les plantes sont cultivées dans un pot (1 pot troué ou 1 pot non troué) ou deux pots (1 pot troué et 1 pot non troué).

Pots des expérimentations
Les plantes : Dans chaque pot un génotype identifié et un seul est semé. Suivant les expérimentations, les génotypes sont répartis de façon aléatoire (tirage au sort) ou par bloc. Au départ plusieurs graines sont semées dans chacun des pots puis les plantes sont éclaircies au fur et à mesure pour ne laisser dans chaque pot que le nombre de plantes suffisant, qui peut varier suivant l'expérimentation et au cours d'une même expérimentation.
Humidité du sol au long de l'expérimentation : le sol utilisé sur les plateformes PHENOPSIS est un mélange 'maison' de sol agricole et de compost organique. La teneur en eau du sol à capacité de rétention est de 0.78 (+/-0.02) g H2O g-1 de sol sec. Pour Col-0, l'humidité du sol est optimale pour la croissance foliaire entre 0.35 and 0.45 g H2O g-1 de sol sec (voir figure). Les symptômes d'anoxie sont visibles pour une humidité du sol supérieure à 0.45 g H2O g-1 de sol sec et le stress hydrique réduit la croissance foliaire pour des valeurs d'humidité du sol inférieures à 0.35 g H2O g-1 de sol sec.
Au démarrage d'une expérimentation, les poids des pots troués et/ou non troués sont déterminés, ainsi que le poids de substrat sec dans chaque pot. Ceci permet par la suite de savoir par simple pesée, à quelle humidité se trouve le substrat à chaque instant dans l'expérimentation, et permet d'ajuster le poids du pot avec une solution nutritive pour atteindre l'humidité cible prédéfinie par l'expérimentateur.
Ces pesées et les ajustements de poids sont effectués automatiquement par l'automate à des heures programmées. Un bras mécanique se déplace sur chaque pot. Ce bras est équipé d'une balance dans sa partie inférieure et d'un capillaire pour l'irrigation dans sa partie supérieure. Le capillaire est relié à une pompe péristaltique. Pour chaque pot, le poids du pot est enregistré (poids avant arrosage), il est comparé au poids cible prédéfini par l'expérimentateur (poids cible) et le poids est ajusté par ajout de solution nutritive si nécessaire (poids après arrosage).
PHENOPSIS 1 et 2 sont équipés d'une seule pompe péristaltique et donc reliés à une seule source de solution nutritive, tandis que PHENOPSIS 3 est équipé de 2 pompes péristaltiques et donc relié à 2 sources de solution nutritive. Les compositions de ces solutions sont définies dans la partie protocole. A chaque irrigation, l'automate enregistre le type A ou B de la solution utilisée.

Irrigation automatique des pots
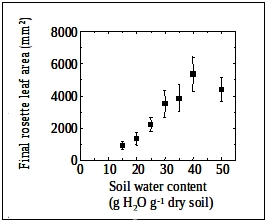
Relation entre la surface finale des feuilles de la rosette et la teneur en eau du sol pour des plantes Col-0 cultivées avec un rayonnement incident journalier de 11 mol m-2 day-1, avec une durée de jour de 12h et un déficit de pression de vapeur feuille-air (VPDfeuille-air) de 0.75 kPa
La prise d'images au cours d'une expérimentation : Une caméra est embarquée sur le bras des automates. Elle permet de prendre des photos des pots individuellement, dans le visible. Sur le bras des automates PHENOPSIS 2 et 3 (C2 et C3), une caméra infra-rouge est embarquée en plus de la caméra dans le visible.
La nécessité ou non de prendre une photo des pots est programmée pour chaque cycle. Dans chaque expérimentation un pot est couvert de papier millimétré permettant de calibrer les images.
Les images dans le visible sont ensuite analysées grâce au logiciel d'analyses d'images ImageJ afin d'obtenir pour chaque plante l'expansion de sa rosette au cours du temps. Les images infra-rouges permettent quant à elles de mesurer les températures de surface de la rosette.


Photo dans le visible et dans l'infra-rouge et croissance de rosette
Les mesures sur les plantes : Certaines mesures sont effectuées de façon régulière sur les plantes et sont non-destructives. Ceci comprend :
- les mesures de surface de rosette ou de surface de feuilles au cours du temps qui sont effectués par analyses d'images sur les phototographies de plantes
- les notations de stades phénologiques (décrits dans Boyes et al., 2001) qui sont effectuées par l'expérimentateur soit à partir des photographies des plantes soit directement sur la plante
- les mesures de photosynthèse et/ou de conductance stomatique.
Définition des stades phénologiques (Boyes et al, 2001)
| Stades phénologiques | Définition |
|---|---|
| Imbibition | Imbibition des graines dans eau à 4°C |
| Semis | Semis des graines dans le sol |
| Stade 0.5 | Emergence de radicule |
| Stade 1.0 | Cotylédons ouverts, horizontaux |
| Stade 1.2 | 2 feuilles > 1mm |
| Stade 1.3 | 3 feuilles > 1mm |
| Stade 1.4 | 4 feuilles > 1mm |
| Stade 1.5 | 5 feuilles > 1mm |
| Stade 1.6 | 6 feuilles > 1mm |
| Stade 1.x | x feuilles > 1mm |
| feuille x initiée | Feuille x initiée sur apex (mesure destructive) |
| Stade 1er bouton floral initié | Bouton floral initié sur apex (mesure destructive) |
| Stade 5.10 | 1ers boutons floraux visibles (bolting stage) |
| Stade 6.00 | 1ère fleur ouverte |
| Stade 6.90 | Toutes fleurs ouvertes |
D'autres mesures nécessitent une récolte de la plante et sont donc destructives. Elles sont en général réalisées à un stade donné. Ce type de mesures comprend :
- les poids sec et frais de la rosette, de certaines feuilles, des pétioles ou du système racinaire
- les mesures de surface et de nombre de cellules épidermiques sur les feuilles ou de densité stomatique
- les mesures d'épaisseur de feuilles et de composition cellulaire des tissus internes
- les surfaces foliaires éclatées mesurées sur des scans des feuilles individuelles
- la longueur totale des racines mesurée sur des scans du systéme racinaire
- les mesures biochimiques ou moléculaires (dosage d'une protéine, d'un transcrit, etc.).

Récolte des plantes
Les scans et autres images de plantes : Des scans des parties racinaires ou foliaires sont réalisés à certaines dates ou certains stades de développement. Ces scans sont ensuite utilisés pour déterminer par analyse d'images (logiciel ImageJ) des surfaces de feuilles, des longueurs de feuilles, .. En ce qui concerne les scans du système foliaire :
- Depuis 2007 les scans possèdent une marque permettant de les calibrer
- Les scans les plus anciens n'ont pas cette marque mais ont été réalisés sur une feuille A4 (longueur 29.7cm et largeur 21cm).
D'autres fichiers sont produits par les expérimentateurs, tels que les images de coupe de feuilles qui permettent de déterminer l'épaisseur des feuilles et leur composition cellulaire.
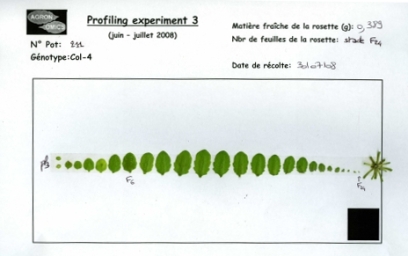
Scan de rosette
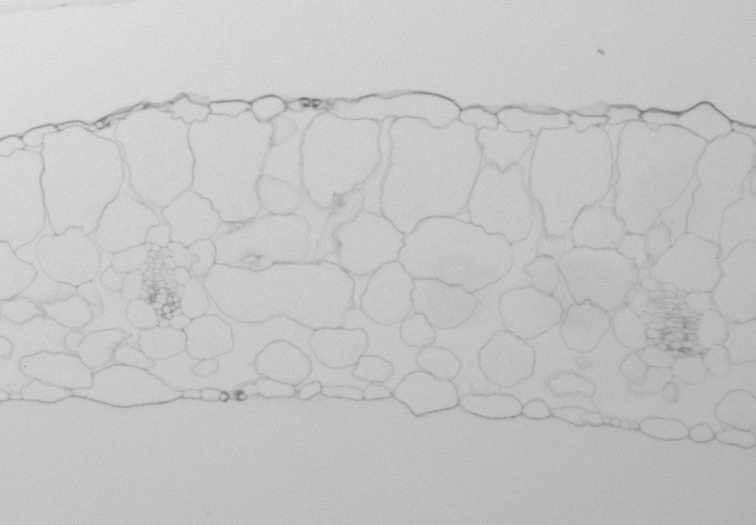
Coupe histologique de feuille



